4,306
5
78
Prompt
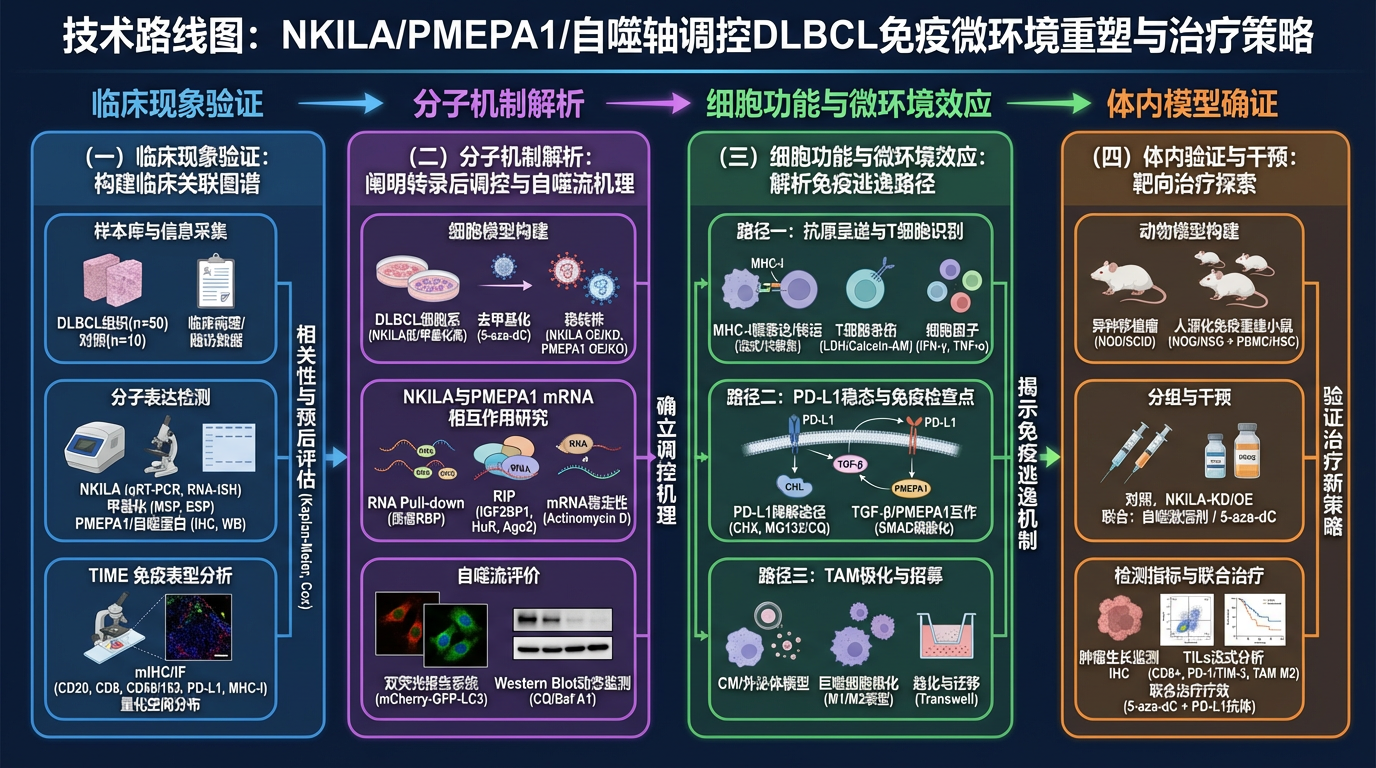
按照以下内容绘制技术路线图,写中文\n3.1 拟采取的研究方案与实验方法\n本研究将遵循“临床现象验证—分子机制解析—细胞功能与微环境效应—体内模型确证”的逻辑路径,采用分子生物学、细胞生物学、免疫学及动物模型等多学科交叉手段展开研究。\n(一)临床样本分析:构建 NKILA/PMEPA1/自噬轴与 TIME 的临床关联图谱\n样本库构建与信息采集: 收集本中心病理科确诊的初治 DLBCL 冰冻及石蜡包埋组织样本(n=50),选取反应性淋巴结增生作为对照(n=10)。收集患者完整的临床病理资料(IPI 评分、COO 分型、LDH 水平等)及随访数据(OS, PFS)。\n分子表达检测:\nNKILA 检测: 提取组织总 RNA,采用 qRT-PCR 检测 NKILA 表达水平;应用RNA 原位杂交(RNA-ISH)技术在组织切片上直观定位 NKILA 的细胞来源(肿瘤细胞 vs 基质细胞)。\n甲基化检测: 提取组织 DNA,经重亚硫酸盐处理后,采用**甲基化特异性 PCR(MSP)**及亚硫酸氢盐测序 PCR(BSP)检测 NKILA 启动子区域甲基化状态。\nPMEPA1 及自噬分子检测: 采用 IHC 和 Western Blot 检测 PMEPA1、Beclin-1、LC3、p62 等蛋白表达。\nTIME 免疫表型分析:\n多重免疫组化/荧光(mIHC/IF): 在同一张切片上标记 CD20(肿瘤 B 细胞)、CD8(细胞毒 T 细胞)、CD68/CD163(M2 型巨噬细胞)、PD-L1、MHC-I 等,利用数字病理扫描与图像分析系统,量化各免疫亚群的密度及空间分布关系。\n统计学分析: 分析 NKILA 甲基化/表达与 PMEPA1、自噬水平及 TIME 特征(如 CD8+ T 细胞浸润密度)的相关性;采用 Kaplan-Meier 和 Cox 回归模型评估该轴线对患者预后的预测价值。\n(二)分子机制解析:阐明 NKILA 转录后调控 PMEPA1 及自噬流的机理\n细胞模型构建: 选取 NKILA 低表达/启动子高甲基化的 DLBCL 细胞系(如 SU-DHL-6, OCI-LY3),利用 5-aza-dC 处理验证去甲基化效应。构建慢病毒稳转株:NKILA 过表达/敲低(shRNA/CRISPRi)、PMEPA1 过表达/敲除(CRISPR/Cas9),以及双基因干预模型(NKILA-KD + PMEPA1-OE)。\nNKILA 与 PMEPA1 mRNA 相互作用研究:\nRNA Pull-down: 设计生物素标记的 NKILA 全长及截短探针,孵育细胞裂解液,通过 qPCR 检测拉下的 PMEPA1 mRNA,并利用质谱鉴定共沉淀的 RNA 结合蛋白(RBPs)。\nRNA 免疫共沉淀(RIP): 针对潜在的 RBPs(如 IGF2BP1, HuR 等)或 Ago2 进行 RIP 实验,验证 NKILA 是否作为支架招募 RBPs 或阻断 miRNA 结合。\nmRNA 稳定性实验: 在 NKILA 干预细胞中加入转录抑制剂放线菌素 D(Actinomycin D),在不同时间点检测 PMEPA1 mRNA 剩余量,计算半衰期。\n自噬流(Autophagic Flux)评价:\n双荧光报告系统: 转染 mCherry-GFP-LC3 质粒,通过共聚焦显微镜观察黄色斑点(自噬体)与红色斑点(自噬溶酶体)的比率,评估自噬流通畅度。\nWestern Blot 动态监测: 在有无溶酶体抑制剂(氯喹 CQ 或 Bafilomycin A1)存在下,检测 LC3-II 的转化及自噬底物 p62 的降解情况。\n(三)微环境重塑效应:解析自噬缺陷驱动免疫逃逸的三大路径\n路径一:抗原呈递与 T 细胞识别\nMHC-I 膜表达与转运: 利用流式细胞术检测细胞表面 MHC-I 分子密度;结合免疫荧光共聚焦,观察 MHC-I 与溶酶体(LAMP1)、自噬体(LC3)的共定位,评估胞内滞留/降解情况。\nT 细胞杀伤实验: 将经不同处理的 DLBCL 细胞与同种异体或抗原特异性 CD8+ T 细胞共培养,通过 LDH 释放实验或 Calcein-AM 释放实验检测 T 细胞杀伤效率;ELISA 检测上清中 IFN-γ、TNF-α 水平。\n路径二:PD-L1 稳态与免疫检查点\nPD-L1 降解途径分析: 使用蛋白质合成抑制剂(CHX)处理细胞,结合蛋白酶体抑制剂(MG132)或自噬/溶酶体抑制剂(CQ),通过 WB 确定 PD-L1 的主要降解途径。\nTGF-β/PMEPA1 信号互作: 利用 TGF-β1 刺激细胞,检测 SMAD2/3 磷酸化及 PD-L1 转录水平;验证 PMEPA1 缺失是否放大 TGF-β 对 PD-L1 的上调作用。\n路径三:TAM 极化与招募\n条件培养基(CM)与外泌体模型: 收集不同 NKILA/自噬状态 DLBCL 细胞的上清液,并提取外泌体。\n巨噬细胞极化实验: 将 CM 或外泌体加入 THP-1诱导的巨噬细胞或健康供者来源的 PBMC-Monocytes,通过流式细胞术(CD86 vs CD206/CD163)和 qPCR(iNOS, TNF-α vs Arg-1, IL-10)检测 M1/M2 极化表型。\n趋化与迁移实验: 利用 Transwell 小室评估 DLBCL 细胞对单核细胞的招募能力。\n(四)体内验证与干预:靶向 NKILA/自噬轴的治疗探索\n异种移植瘤模型(Xenograft): 在 NOD/SCID 小鼠皮下接种稳定转染 NKILA/PMEPA1 基因的 DLBCL 细胞,监测肿瘤生长曲线。处死后行 IHC 检测 Ki67、Cleaved-Caspase3 及自噬标志物。\n人源化免疫重建小鼠模型(Humanized Mice): 为验证免疫微环境改变,利用 NOG/NSG 小鼠移植人 PBMC 或 CD34+ 造血干细胞,重建人源免疫系统,随后接种 DLBCL 细胞。\n分组: 对照组、NKILA-KD 组、NKILA-OE 组、NKILA-KD + 自噬激活剂(如 Rapamycin)组、NKILA-KD + 5-aza-dC 组。\n检测指标: 监测肿瘤生长;流式细胞术分析肿瘤浸润淋巴细胞(TILs)中 CD8+ T 细胞的比例、耗竭标志物(PD-1, TIM-3)表达及 TAM 的 M2 极化比例。\n联合治疗探索: 评估去甲基化药物(5-aza-dC)联合 PD-L1 抗体在体内模型中的疗效,验证恢复 NKILA 是否能增敏免疫治疗。
Details
- Size
- 1376 x 768